这要从摩尔质量、相对原子质量以及阿伏伽德罗常数的定义上去理解。
相对原子质量: 某原子的质量与 C-12 原子质量的 1/12 的比值叫该原子的相对原子质量。单位: 1 ,通常省略不写。
摩尔质量: 单位物质的量某物质所具有的质量,单位 g/mol 。
阿伏伽德罗常数: 1mol 某物质所含的微粒数,该数值与 12g C-12 单质所含的原子个数相同,单位: mol-1 。
假设现在有一种原子,符号 X 。
① 根据定义计算相对原子质量:
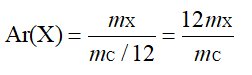
(m
X
表示一个X原子的质量,m
C
表示一个C-12原子的质量,下同)
② 根据定义求阿伏伽德罗常数:
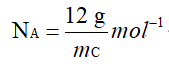
②
根据定义计算
X
的摩尔质量:
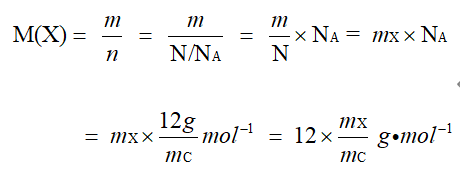
(m 表示 X 物质的总质量, n 表示 X 原子的物质的量, N 表示所含 N 原子的数目 )
从上面推导我们可以看出,摩尔质量确实只比相对原子质量多了一个 g/mol 的单位,数值上是完全相同的。
这个巧合是因为二者 都是以 C-12 为参照 ,并且一个取了 C-12 原子质量的 1/12 ,一个取了 12g C-12 单质 。但凡这三个量中有一个改变了,这两者都不会这么巧合的数值相等而单位不同。我们来看一道例题:
【例】若以一个C-12 的原子质量的 1/24 作为相对原子质量的标准 , 下列说法不正确的是( )
A. C-12 的相对原子质量变为 24
B. 与4g H 2 化合的O 2 的质量为32g
C. 25℃ 时 , 硝酸钾的溶解度不变
D. 4℃ 时 , 水的密度变为 2g/mL
分析:若以一个 C-12 的原子质量的 1/24 作为相对原子质量的标准,则
Ar(X)= m X / (m C /24 ) = 24m X / m C
摩尔质量和阿伏伽德罗常数题干中没有涉及,就默认不变。所以摩尔质量仍为:
M(X)=12m X / m C g/mol
所以此时相对原子质量数值上就不等于摩尔质量了,而是摩尔质量的两倍。
A中,12C的相对原子质量= 24m C / m C =24,正确。
B中,摩尔质量定义不变,所以用质量算物质的量的方法、数值也都不变,因此4g H 2 仍是2mol,可以与1mol O 2 反应,也就是32g。正确。
C 中,溶解度是一定温度下 100g 水中溶解某物质达到饱和所能溶解的质量,这与相对原子质量、摩尔质量等都无关,因此溶解度不会改变。正确。
D 中,密度定义是ρ = m / V ,这与今天将的概念也没有关系,所以密度也不变,仍为 1g /mL 。错误。
所以,选 D