伯克利新闻
| 罗伯特·桑德斯 | 30 年 2020 月 XNUMX 日
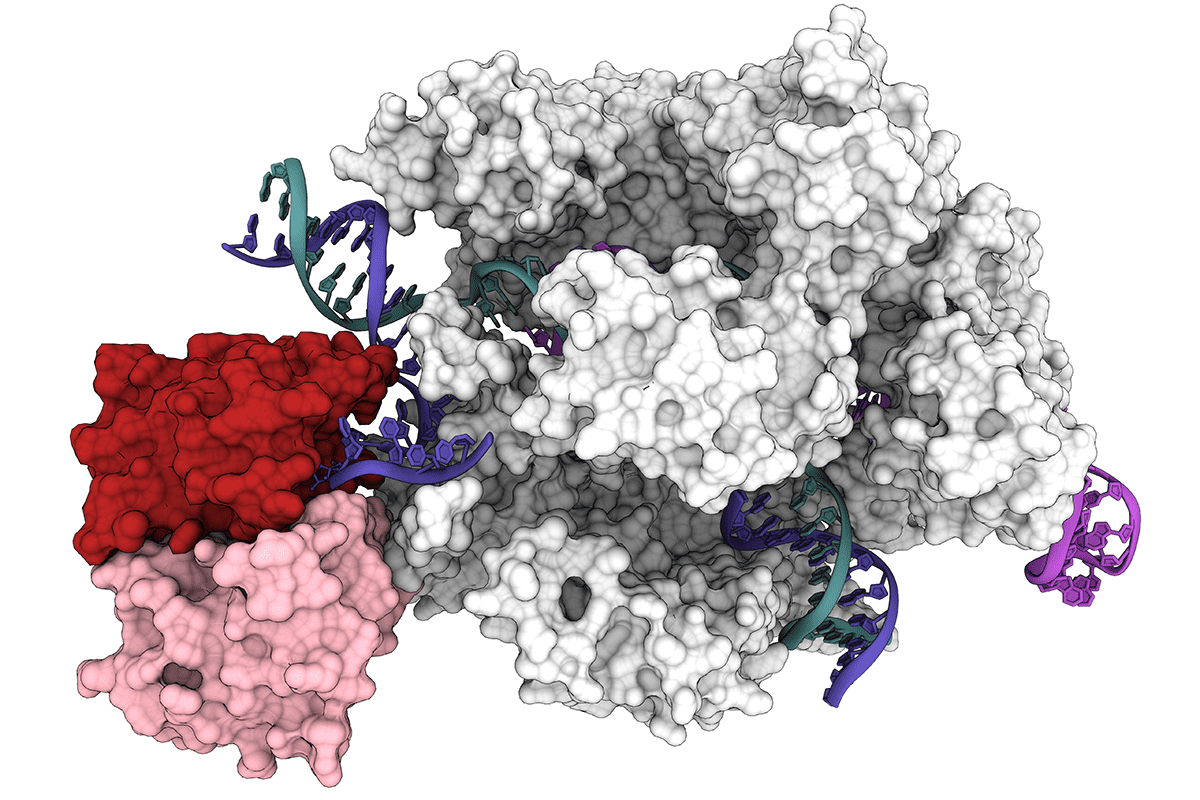 碱基编辑器的 3D 结构,由 Cas9 蛋白(白色和灰色)和脱氨酶蛋白(红色和粉红色)和脱氨酶蛋白(红色和粉红色)组成,该蛋白与 DNA 靶标(蓝绿色和蓝色螺旋)结合,与 RNA 指导(紫色)互补,将一种核苷酸换成另一种核苷酸。
碱基编辑器的 3D 结构,由 Cas9 蛋白(白色和灰色)和脱氨酶蛋白(红色和粉红色)和脱氨酶蛋白(红色和粉红色)组成,该蛋白与 DNA 靶标(蓝绿色和蓝色螺旋)结合,与 RNA 指导(紫色)互补,将一种核苷酸换成另一种核苷酸。
短短八年时间,
CRISPR
-
Cas9
已成为首选
基因组
基础研究和编辑
基因治疗
. 但 CRISPR-Cas9 也催生了其他潜在的强大
的DNA
可以帮助修复遗传的操作工具
突变
负责遗传性疾病。
加州大学伯克利分校的科学家现在已经获得了这些工具中最有前途的工具之一的第一个 3D 结构:
碱基编辑器
,它与 DNA 结合,而不是切割,而是精确地替换一个
核苷酸
和另外一个。
四年前首次创建,
基地
编辑器已经被用于尝试纠正人类基因组中的单核苷酸突变。 现在可用的碱基编辑器可以解决大约 60% 的所有已知遗传疾病——可能超过 15,000 种遗传疾病——由仅一个核苷酸的突变引起。
详细的 3D 结构,发表在 31 月 XNUMX 日的期刊上
科学
,提供了调整碱基编辑器的路线图,使它们在患者中使用时更加通用和可控。
加州大学伯克利分校博士后研究员 Gavin Knott 说:“我们第一次能够观察到一个碱基编辑器在运行。” “现在我们不仅可以了解它什么时候起作用,什么时候不起作用,而且还可以设计下一代碱基编辑器,使它们更好、更适合临床。”
碱基编辑器是一种 Cas9 融合
蛋白质
使用部分停用的 Cas9 - 它的剪刀被禁用,因此它只剪一个
缕
DNA——和一个
酶
例如,激活或静音
基因
,或修改相邻的 DNA 区域。 因为这项新研究报告了 Cas9 融合蛋白的第一个结构,它可以帮助指导无数其他基于 Cas9 的基因组编辑工具的发明。
“我们实际上第一次看到碱基编辑器作为两个独立的模块运行:你有一个 Cas9 模块为你提供特异性,然后你有一个催化模块为你提供活性,”前加州大学伯克利分校的 Audrone Lapinaite 说博士后研究员,现在是坦佩亚利桑那州立大学的助理教授。 “我们得到的这种碱基编辑器与其目标结合的结构确实让我们有办法思考 Cas9 融合蛋白,总的来说,让我们了解 Cas9 的哪个区域对融合其他蛋白质更有利。”
最近接受澳大利亚莫纳什大学研究员职位的 Lapinaite 和 Knott 是该论文的共同第一作者。
“这种结构帮助我们在更深的层次上理解碱基编辑器,”资深作者、加州大学伯克利分校分子学教授詹妮弗·杜德纳 (Jennifer Doudna) 说。
手机
生物学和创新的创始人兼董事会主席
基因组学
研究所。 “现在我们可以看到我们正在使用什么,我们可以制定明智的策略来改进系统。”
一次编辑一个基地
2012 年,研究人员首次展示了如何重新设计一个
细菌
Cas9 酶,并将其转变为所有类型细胞(从细菌到人类)中的基因组编辑工具。 Doudna 和她的法国同事 Emmanuelle Charpentier 的心血结晶 CRISPR-Cas9 已经改变了生物学研究,并将基因治疗引入临床,这是几十年来的第一次。
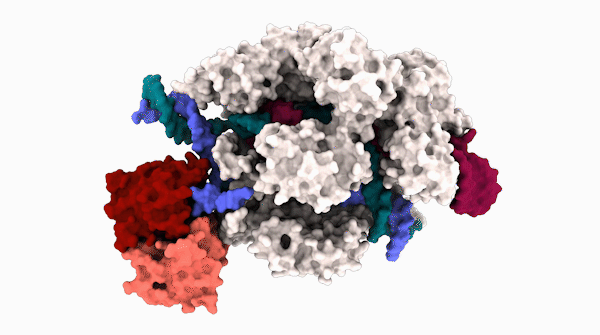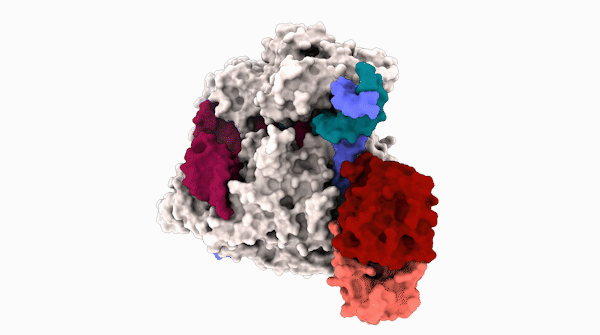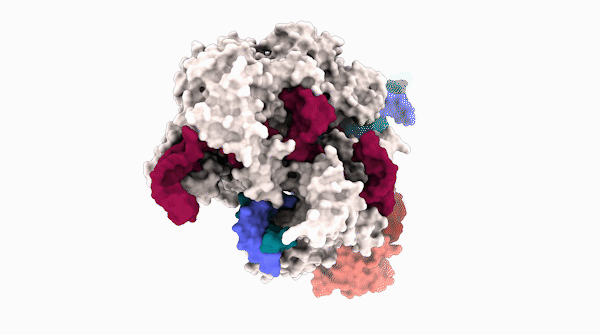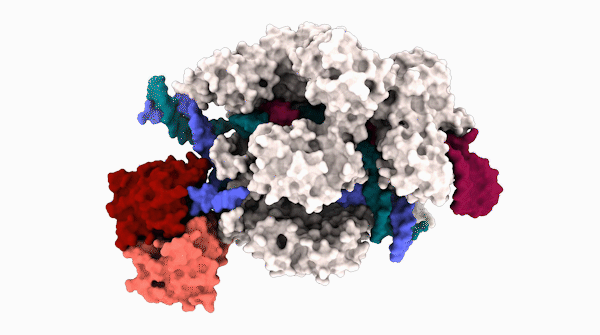 碱基编辑器在编辑一段 DNA 时的 3D 结构。
碱基编辑器在编辑一段 DNA 时的 3D 结构。
科学家们很快就选择了 Cas9 来生产一系列其他工具。 基本上是蛋白质和
RNA
,Cas9 精确地瞄准一段特定的 DNA,然后精确地剪断它,就像一把剪刀。 然而,剪刀功能可以被破坏,从而允许 Cas9 在不切割的情况下靶向和结合 DNA。 通过这种方式,Cas9 可以将不同的酶运送到 DNA 的目标区域,使酶能够操纵基因。
2016 年,哈佛大学和麻省理工学院布罗德研究所的 David Liu 将 Cas9 与另一种细菌蛋白质结合,以通过外科手术精确地将一种核苷酸替换为另一种核苷酸:第一个碱基编辑器。
虽然早期的腺嘌呤碱基编辑器很慢,但最新版本的 ABE8e 却快得令人眼花缭乱:它在 100 分钟内完成了近 15% 的预期碱基编辑。 然而,ABE8e 可能更容易在试管中编辑意外的 DNA 片段,可能会产生所谓的
不中
影响。
新发现的结构是通过一种称为冷冻电子显微镜 (cryoEM) 的高功率成像技术获得的。 活性测定显示了为什么 ABE8e 容易产生更多的脱靶编辑:与 Cas9 融合的脱氨酶蛋白始终处于活性状态。 当 Cas9 在细胞核周围跳跃时,它会在找到预定目标之前结合并释放成百上千个 DNA 片段。 附加的脱氨酶就像一门松散的大炮,不会等待完美匹配,并且经常在 Cas9 停留在其最终目标上之前编辑碱基。
了解效应结构域和 Cas9 是如何连接的,可以重新设计,使酶只有在 Cas9 找到其目标时才具有活性。
“如果你真的想设计真正特定的融合蛋白,你必须找到一种方法让催化结构域更多地成为 Cas9 的一部分,这样当 Cas9 位于正确的目标上时才会被感知,然后才被激活,而不是被一直活跃,”拉皮奈特说。
ABE8e 的结构还指出了脱氨酶蛋白的两个特定变化,使其比碱基编辑器的早期版本 ABE7.10 工作得更快。 这两个点突变使蛋白质能够更紧密地抓住 DNA,并更有效地将 A 替换为 G。
“作为一名结构生物学家,我真的很想观察一个分子并思考如何合理改进它。 这种结构和伴随的生物化学确实给了我们这种力量,”诺特补充道。 “我们现在可以对这个系统在细胞中的行为做出合理的预测,因为我们可以看到它并预测它会如何破裂或预测如何使它变得更好。”
“虽然碱基编辑器现在被广泛用于在从细菌到植物再到灵长类动物的生物体中引入精确的变化,但之前没有人观察到碱基编辑器的三维分子结构,”刘说,他也是霍华德休斯医学研究所研究者。 “这个合作项目揭示了一个最先进的、高度活跃的碱基编辑器——ABE8e——在参与目标 DNA 位点的行为中的美丽分子结构。”
除了 Lapinaite、Knott、Doudna 和 Liu,其他论文合著者还有加州大学戴维斯分校的 Cody Palumbo 和 Peter Beal、加州大学伯克利分校和 IGI 的 Enrique Lin Shiao,以及 Broad Institute 的 Michelle Richter 和 Kevin Zhao在哈佛和麻省理工学院之间。
-
通过 CRISPR-Cas9 引导的腺嘌呤碱基编辑器捕获 DNA
(
科学
)
-
杜德纳实验室网站
奥黛丽·拉皮奈特:audrone.lapinaite@asu.edu
加文·诺特:gavin.knott@berkeley.edu, gavin.knott@monash.edu
安迪·默多克:andymurdock@berkeley.edu

