人教版高中化学必修一 离子反应 公开课优质课课件教案视频
《离子反应》第二课时教学设计
一、教材分析
本章以分类为中心,介绍物质的分类、化学反应的分类。第二节《离子反应》从有无离子参加的角度认识化学反应。第一课时学习酸、碱、盐在水溶液中的电离情况,并从电离的角度深化酸、碱、盐的定义,水到渠成的转入离子反应的讨论。第二课时从概念出发,结合探究实验总结离子反应发生的条件。本节内容在中学阶段占有极其重要的地位,贯穿于中学化学教材的始终。在中学化学中要学习许多重要元素及其化合物的知识,都可能涉及离子反应及其方程式的书写。学好这一节内容,能揭示溶液中化学反应的本质。既巩固了前面已学过的电离初步知识,又为后面元素化合物知识、电解质溶液的学习奠定了一定的基础。
二、学情分析
学生在学习本节课之前,对溶液的导电性,电解质的概念、复分解反应的概念等知识已有一定的认识,知道电解质在溶液中能电离出离子,复分解反应发生的条件,知道酸、碱、盐的溶解性。但是学生刚进高一,元素化合物知识不丰富,电离理论初步接触,因此本节知识对学生来说具有一定的难度。
学生正处在15、16岁的年龄阶段,好奇心较强,兴趣不太稳定,逻辑思维正在日趋发展中,在知识学习上仍需借助感性材料的支持。
根据以上分析及《化学新课程标准》,确定本节课的教学目标、重难点和教学方法如下:
三、教学目标
(一)知识与技能
1.使学生了解离子反应和离子反应方程式的含义。
2.通过实验事实认识离子反应及其发生的条件。
3.使学生掌握简单的离子反应方程式的书写方法。
(二)过程与方法
通过交流、发言、实验等培养学生的思维能力、语言表达能力、动手能力,观察能力、自学能力及分析问题、解决问题的能力,教给学生科学的方法,加深对所学知识的理解。
(三)情感态度与价值观
1.学生通过实验,体验了实验是学习化学和探究化学过程的重要途径。
2.培养学生对科学的好奇心与求知欲,使之善于观察,敢于实践.
3.通过讨论与交流等活动,培养学生与他人进行交流与反思的习惯。发扬与他人合作的精神,分享实验探究成功后的喜悦之情。感受同学间的相互合作与取得成功的关系。
教学重点与难点
重点: 离子反应的实质和离子反应方程式的书写方法。
难点:实验现象的分析、离子反应方程式的书写。
四、教学方法
实验探究;学案导学
难点突破:
1.精心设计实验:将教材实验设计为4个学生为一组的学生实验,培养学生的动手能力、合作精神。使每个学生参与到获得知识的过程中,能分享实验探究成功后的喜悦之情。感受同学间的相互合作与取得成功的关系。
2.离子方程式的书写是本节课的难点。为突破该难点,我做如下设计:初学时让学生按书写步骤进行训练。第二步是正确书写离子反应方程式的关键和难点。学生的主要错误是不熟悉,不知道也不熟悉哪些能改写成离子,哪些不能改写离子,要指导学生复习酸、碱、盐的溶解性(课本第110页)。采用自学、反馈练习、纠正错误的方法,使同学们对自己所犯的错误得到及时的纠正。并且要将书写难点分散到其他教学环节,在学习离子反应的意义时,设计练习4个离子方程式的书写。在得出离子反应发生的条件时,设计练习3个书写。
五、学习方法
采用实验探究与交流活动相结合,锻炼学生的思维能力、动手能力,培养学生交流与自主学习的习惯。
六、、教学准备
1.实验仪器:试管、试管架、胶头滴管、毛刷。
2.实验药品:0.5mol/LCuSO4溶液、0.5mol/LKCl溶液、酚酞溶液、0.5 mol/LBaCl2溶液、1mol/LNaOH溶液、1mol/LHCl溶液、0.5mol/L Na2CO3溶液。
3.学生准备:4人一组进行实验。
七、教学过程
总体构思:
教学序 :创设情境→提出问题→引导探究→实验研究→引导分析→引导归纳→巩固练习
学习序 :明确问题→实验研究→分析现象→形成概念→理解应用
【复习旧课导入新课】
1、在下列物质中:①CH3COOH ②HCl ③NaOH ④Cu(OH)2 ⑤AgCl ⑥Na2CO3 ⑦C2H5OH ⑧H2O ⑨SO2⑩Fe
属于电解质的是______ ______
属于非电解质的是_________ ___
2、展示硫酸铜溶液和氯化钡溶液,通过学生书写它们的电离方程式及化学反应方程式,得出它们之间的反应是——离子反应 —— 引出今天要探讨的课题——离子反应及其发生条件。
【板书】
第二节 离子反应
二、离子反应及其发生条件
【展示学习目标】
1理解离子反应的概念。
2.掌握复分解型离子反应发生的条件。
3.能正确书写常见的离子方程式。
【学生实验探究2-1】探究离子反应的本质

【学生讨论、交流】从离子变化的角度分析上述现象。
【学生得出结论】
一位同学代表小组发言。
【总结】CuSO4溶液与KCl溶液并没有发生化学反应,只是CuSO4电离出来的Cu2+、SO42-与KCl电离出来的K+、Cl-的混合;而CuSO4溶液与BaCl2溶液则发生了化学反应,生成了BaSO4沉淀:CuSO4溶液与BaCl2溶液反应的实质就是SO42-和Ba2+反应生成BaSO4沉淀。化学方程式:CuSO4+BaCl2=CuCl2+BaSO4↓ 本质:SO42-+Ba2+= BaSO4↓
引出离子方程式的定义——用实际参加反应的离子符号表示离子反应的式子叫离子方程式。
【老师过渡】
`离子方程式比化学方程式能从本质上反映化学反应,但是离子反应方程式的书写是一个很复杂的问题,要正确的书写一个离子方程式,还要掌握离子方程式的书写步骤。
【学生自主学习】离子方程式的书写步骤(课本32页)
例:Na2SO4+BaCl2=2NaCl+BaSO4↓
1、写出化学方程式:
2、把易溶于水且易电离的物质拆写成离子形式,难溶或难电离的物质以及气体等仍用化学式表示。
3、删去方程式两边形式相同的离子(实质是不参加反应的离子)。
4、整理方程式并检查两边各元素的原子个数和电荷总数是否相等。
【老师重点讲解】
离子方程式的书写可以概括为:“写、拆、删、查”四个步骤。第二步对同学们学生来说是最困难的,其中的“两个易”不好掌握,哪些应该改写成离子?哪些必须要用化学式,往往同学们不能准确判断,需要同学们慢慢的去掌握,这不是急于求成的事情。随着同学们知识的积累,会越来越好的。
【板书】写成离子的物质:
易溶且易电离:强酸、强碱和易溶的盐,其余的均写成化学式。
【学生练习】
用离子方程式表示下列反应:
1、硫酸中加入氢氧化钾溶液
2、氢氧化铜溶于稀硫酸
3、碳酸钙溶于盐酸
【学生板演】
【老师点评】
【学生练习】不同酸、碱中和反应中离子方程式的书写:
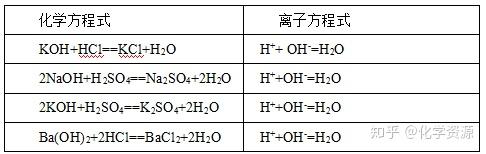
【学生讨论】上述四个中和反应的化学方程式各不相同,但它们的离子方程式却都是相同的,这说明了什么?
【教师总结】
1.酸碱中和的实质是酸电离出来的H+与碱电离出来的OH-结合生成了H2O。H++OH-=H2O表示强酸与强碱反应生成可溶性盐和水的反应。
2.离子方程式揭示了化学反应的本质。
3.不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应。
【教师板书】
离子反应方程式的意义:不仅可以表示某一个具体的化学反应,而且还可以表示同一类型的离子反应。
【思考与交流】
下列离子方程式能表示哪些物质之间的反应?能写出化学方程式吗?
⑴Ca2++CO32—=CaCO3↓
⑵Cu2++2OH—=Cu(OH)2↓
⑶CO2+2OH—=CO32—+H2O
⑷BaCO3+2H+=Ba2++ H2O+CO2↑
【教师过渡】哪些离子之间可以反应呢?
【学生实验探究2-3】探究离子反应发生的条件
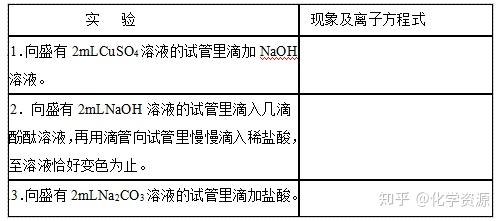
【学生讨论、交流】实验现象、离子方程式。
每个实验派一位同学代表小组发言
结论: 1. 有蓝色沉淀 Cu2++2OH-=Cu(OH)2↓
2.红色逐渐消失 H++OH-=H2O
3.放出气泡 2H++CO32-=H2O+CO2↑
【学生讨论总结】
两种电解质在溶液中发生离子反应的条件是什么?
结论:这类离子反应发生的条件是:产生沉淀、放出气体、生成水。
【思考与交流】
下列各组离子在溶液中不能大量共存的是 ( )
A.Na+、Ba2+、Cl—、SO42— B.K+、SO42—、NO3—、OH—
C.H+、NH4+、Fe3+、SO42— D.H+、Cl—、CO32-、NO3—
【老师过渡】
--- 学习离子反应有很大的用途,如:
1、检验某些离子的存在。
2、用于混合物的提纯。
3、消除水中的污染物
4、离子共存问题
5、有关除杂质的问题
离子反应的应用我们将在下一节课继续研究和讨论。
【老师小结】
这节课我们通过实验探究认识了离子反应的本质是反应的离子浓度减少;知道了电解质溶液发生离子反应的条件是产生沉淀、气体或水);学会了简单的离子方程式的书写。
【作业布置】 完成课本第34页练习
- 引言
- 第一章 从实验学化学
- 第一节 化学实验基本方法
- 第二节 化学计量在实验中的应用
- 归纳与整理
- 第二章 化学物质及其变化
- 第一节 物质的分类
- 第二节 离子反应
- 第三节 氧化还原反应
- 归纳与整理
- 第三章 金属及其化合物
- 第一节 金属的化学性质
- 第二节 几种重要的金属化合物
- 第三节 用途广泛的金属材料
- 归纳与整理
- 第四章 非金属及其化合物
- 第一节 无机非金属材料的主角——硅
- 第二节 富集在海水中的元素——氯
- 第三节 硫和氮的氧化物
- 第四节 氨 硝酸 硫酸
- 归纳与整理

